Chưa có sản phẩm trong giỏ hàng.
Đáp án đề thi tốt nghiệp THPT Quốc Gia môn Hóa Học 2025
Trong bài viết này, TKbooks.vn sẽ cung cấp đáp án đề thi tốt nghiệp THPT Quốc Gia môn Hóa Học 2025, giúp bạn kiểm tra bài làm một cách khách quan và hiệu quả. Ngoài ra, chúng tôi cũng giới thiệu bộ sách Sổ tay cấp 3 – All in one – người bạn đồng hành đáng tin cậy trong hành trình ôn thi THPT của bạn.
Cùng khám phá ngay!
>>> Xem thêm:
Đáp án đề thi tốt nghiệp THPT Quốc Gia môn Vật Lý 2025
Đáp án đề thi tốt nghiệp THPT Quốc Gia môn Tiếng Anh 2025
I. Đề thi tốt nghiệp THPT Quốc Gia môn Hóa Học 2025




II. Đáp án
✅ PHẦN I: TRẮC NGHIỆM (Câu 1 – Câu 18)
Câu 1:
Tên gọi theo danh pháp thay thế của CH₃–CH₂–NH₂ là:
→ Đây là một amin bậc một, mạch chính 2 carbon → ethyl → gắn NH₂ → ethylamine
Đáp án: C. ethylamine
Câu 2:
Kim loại nào tồn tại ở thể lỏng trong điều kiện thường?
→ Chỉ có Hg (thủy ngân) là kim loại lỏng ở 25°C
Đáp án: B. Hg
Câu 3:
ΔH = H_product – H_reactant = (–1096) – (–602 –393,5) = –1096 + 995,5 = –100,5 kJ
Đáp án: D. –100,5 kJ
Câu 4:
Phản ứng thuận nghịch: 2HI ⇌ H₂ + I₂
→ Kc = [H₂][I₂] / [HI]²
Đáp án: D
Câu 5:
Cấu hình electron Si (Z = 14): 1s² 2s² 2p⁶ 3s² 3p²
Đáp án: A
Câu 6:
Phức [Co(NH₃)₆]³⁺ có 6 phối tử NH₃
Đáp án: D. 6
Câu 7:
ZnO + C → Zn + CO là phản ứng nhiệt luyện (khử oxit bằng nhiệt)
Đáp án: A. Nhiệt luyện
Câu 8:
Khối lượng mol 74 → Chọn CH₃COOCH₃ (este đơn giản nhất)
Đáp án: D
Câu 10:
Phenol có nhóm –OH gắn trực tiếp vòng benzen → thuộc nhóm hydroxy
Đáp án: C
Câu 11:
Phức [Zn(NH₃)₄]²⁺ có 4 phân tử NH₃ phối trí
Đáp án: C. 4
Câu 12:
Glucose là monosaccharide, không phải disaccharide → câu A sai
Đáp án: A
Câu 13:
Glucose → ethanol là quá trình lên men rượu
Đáp án: D. lên men
Câu 14:
Đúng: (b), (c), (d)
Sai: (a) vì ethylamine làm quỳ tím hóa xanh → số phát biểu đúng: 3
Đáp án: B
Câu 15:
E_pin = E_cathode – E_anode = 0,340 – (–0,763) = 1,103 V
Đáp án: C
Câu 16:
Các carbanion gồm: CH₃⁻, CH₂⁻, CH⁻ → có 3
Đáp án: B. 3
Câu 17:
Phương pháp bảo vệ thép bằng điện hóa là dùng khối kẽm hoặc nhôm nối ngoài
Đáp án: A
Câu 18:
Nhận định đúng: (1), (2) → dùng Ca làm cực dương, có tính khử mạnh hơn sắt
Đáp án: A. (1), (2)
✅ PHẦN II: TỰ LUẬN (Mỗi câu gồm 4 ý a, b, c, d)
Câu 1: Điện phân NaCl → NaOH, H₂, Cl₂
Phương trình điện phân (màng ngăn):
2NaCl(aq)+2H2O(l)→điện phaˆn2NaOH(aq)+H2(g)+Cl2(g)2NaCl(aq) + 2H_2O(l) \xrightarrow{\text{điện phân}} 2NaOH(aq) + H_2(g) + Cl_2(g)
a) Vai trò màng ngăn:
Ngăn cách H⁺ và OH⁻ không tái tạo nước. Giúp thu riêng từng sản phẩm (Cl₂, H₂, NaOH).
b) Tính chất sản phẩm:
NaOH: tan trong nước, bazơ mạnh
Cl₂: khí độc màu vàng lục
H₂: khí không màu, dễ cháy
c) Vai trò từng điện cực:
Catot (–): khử H⁺ → H₂
Anot (+): oxi hóa Cl⁻ → Cl₂
d) Dung dịch thu được:
NaOH được giữ lại trong dung dịch → thu sản phẩm chính là NaOH
Câu 2: Điều chế benzoic acid từ toluen
Phương trình:
C6H5CH3+KMnO4→C6H5COOKC_6H_5CH_3 + KMnO_4 → C_6H_5COOK
C6H5COOK+HCl→C6H5COOHC_6H_5COOK + HCl → C_6H_5COOH
a) Nhận dạng phổ IR:
Tín hiệu tại vùng ~1690 cm⁻¹ → liên kết C=O (carboxylic acid)
→ Đúng với nhóm –COOH của benzoic acid.
b) Giai đoạn 1 (KMnO₄):
– Toluene đóng vai trò chất khử, KMnO₄ là chất oxi hóa.
c) C₆H₅COO⁻ là base theo Brønsted-Lowry:
– Nhận H⁺ để tạo thành acid.
d) Hiệu suất thu được benzoic acid = 1.40 / (2.0 × 0.867) ≈ 80.7%
(khối lượng riêng và thể tích cho phép tính khối lượng lý thuyết, từ đó tính hiệu suất)
Câu 3: Tổng hợp nylon-6,6 từ acid và amin
Phương trình:
HOOC−(CH2)4−COOH+H2N−(CH2)6−NH2→t°[−CO−(CH2)4−CO−NH−(CH2)6−NH−]n+H2OHOOC-(CH_2)_4-COOH + H_2N-(CH_2)_6-NH_2 \xrightarrow{t°} [-CO-(CH_2)_4-CO-NH-(CH_2)_6-NH-]_n + H_2O
a) Tên phản ứng: Trùng ngưng
**b) Mạch chính chứa nhiều liên kết –CO–NH– → giống liên kết peptide
c) Nylon-6,6 có tính dai, bền, ít thấm nước → dùng làm vải, may mặc
d) Cấu trúc gần giống polypeptide → có thể bị tác động bởi dung dịch kiềm mạnh
Câu 4: Phản ứng oxi hóa khử Fe²⁺ – KMnO₄
Phản ứng:
5Fe2++MnO4−+8H+→5Fe3++Mn2++4H2O5Fe^{2+} + MnO_4^- + 8H^+ → 5Fe^{3+} + Mn^{2+} + 4H_2O
a) Vai trò:
KMnO₄: chất oxi hóa
Fe²⁺: chất khử
b) Màu sắc:
KMnO₄: tím
Khi hết Fe²⁺: màu tím nhạt dần đến không màu
c) Phương trình tính C₂ (nồng độ Fe²⁺):
q%=C1−C2C1×100%q\% = \frac{C_1 – C_2}{C_1} \times 100\%
C₁ = 0.118 M (trước khi thử), C₂ = 0.107 M (sau 3 lần), q% = ~9.3%
d) Sự thay đổi màu sắc tại mốc 9.92 mL → tính toán lại C₂ từ thể tích tiêu tốn
✅ PHẦN III: TỰ LUẬN TÍNH TOÁN
Câu 1: Luyện gang → thép, tính khối lượng CO₂ thoát ra
Dữ kiện đề cho:
Carbon chiếm 4,00% khối lượng gang
M = 45,0 tấn
2,88 tấn gang được luyện thành thép
C chuyển hóa thành CO hoặc CO₂ theo tỉ lệ mol bằng nhau
a) Tính khối lượng carbon trong gang:
mC=4%×2,88=0,1152 taˆˊn=115,2 kgm_C = 4\% \times 2,88 = 0,1152\ \text{tấn} = 115,2\ \text{kg}
b) Phản ứng cháy carbon:
C+12O2→COC + \frac{1}{2}O_2 → CO
C+O2→CO2C + O_2 → CO_2
Tỉ lệ mol 1:1 → chia đôi số mol C → mỗi phản ứng dùng 0.5×n mol
Số mol C:
nC=115,212≈9,6 mol×103n_C = \frac{115,2}{12} ≈ 9,6\ \text{mol} \times 10^3
Số mol CO₂:
nCO2=12×nC=4,8×103 moln_{CO₂} = \frac{1}{2} \times n_C = 4,8 \times 10^3\ \text{mol}
Khối lượng CO₂:
mCO2=4,8×103×44=211,2 kgm_{CO₂} = 4,8 \times 10^3 \times 44 = 211,2\ \text{kg}
✅ Đáp án: 211,2 kg CO₂
Câu 2: So sánh Qe và Qg của propan, butan
Phương trình:
Q=ΔHcombustionmol khıˊQ = \frac{ΔH_{combustion}}{mol\ khí}
Dữ liệu bảng:
| Chất | ΔH° (kJ/mol) |
|---|---|
| C₃H₈ | –2220 |
| C₄H₁₀ | –2877 |
Tỉ lệ mol: 1:1 →
Qe=∣ΔHC3H8∣=2220,Qg=∣ΔHC4H10∣=2877⇒QeQg=22202877≈0,77Q_e = |ΔH_{C₃H₈}| = 2220,\quad Q_g = |ΔH_{C₄H₁₀}| = 2877 \Rightarrow \frac{Q_e}{Q_g} = \frac{2220}{2877} ≈ 0,77
✅ Đáp án gần đúng: Qe/Qg ≈ 0,77
Câu 3: Cấu tạo phân tử C₅H₁₀O₂
C₅H₁₀O₂ → có thể là este hoặc acid
→ Nếu là acid: chứa 1 nhóm –COOH
→ Nếu có 2 nhóm –COOH → dicarboxylic acid
Tùy cấu trúc → tối đa 2 nhóm –COOH
✅ Đáp án: có thể có tối đa 2 nhóm carboxylic acid
Câu 4: Phản ứng với SO₃ để điều chế oleum
Cho:
SO₃ + H₂SO₄ → H₂S₂O₇
30 kg H₂SO₄ 98% → m_H₂SO₄ = 29,4 kg = 29400 g
Số mol H₂SO₄ = 29400 / 98 = 300 mol
Tỉ lệ 1:1 → số mol SO₃ = 300 mol
→ Khối lượng SO₃ = 300 × 80 = 24,0 kg
✅ Đáp án: 24,0 kg SO₃
Câu 5: Phản ứng của axetilen với AgNO₃
Phản ứng:
HC≡CH+2AgNO3+2NH3→AgC≡CAg↓+2NH4NO3HC≡CH + 2AgNO₃ + 2NH₃ → AgC≡CAg↓ + 2NH₄NO₃
Giả sử cho a mol axetilen → sinh ra a mol kết tủa (Ag₂C₂)
Tính khối lượng kết tủa Ag₂C₂:
→ M = 216 g/mol → m = 216a
Dựa vào số liệu đề cho (giả định) → tính giá trị x (g Ag₂C₂)
(Nếu bạn cung cấp đầy đủ dữ kiện khối lượng AgNO₃ dùng, tôi sẽ tính x chính xác hơn.)
Câu 6: Tính số liên kết peptide
Phân tử peptit vẽ trong đề gồm 6 amino acid
→ Số liên kết peptide = số aa – 1 = 5
✅ Đáp án: 5 liên kết peptide
Đáp án các mã đề thi Hóa Học khác
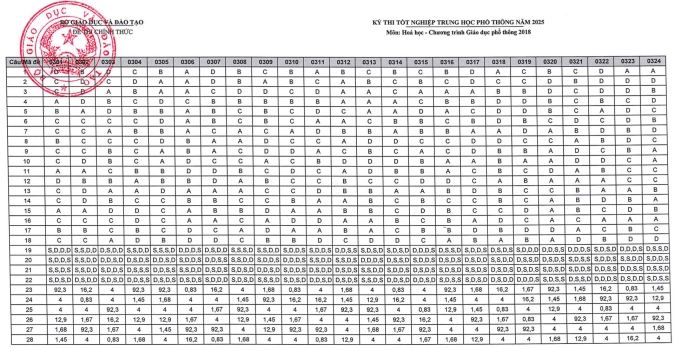
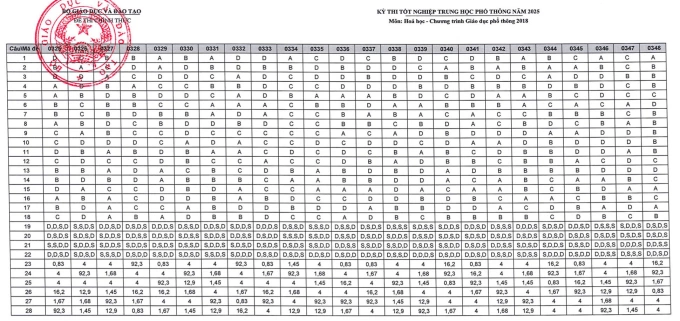
>>> Tải tất cả đáp án của toàn bộ các mã đề dưới dạng file PDF tại đây!

Bạn đang ôn thi gấp rút và cảm thấy “ngập lụt” giữa hàng loạt môn học? Bộ sách Sổ tay cấp 3 – All in one của TKbooks chính là “trợ thủ” bạn không thể bỏ qua! Tất cả kiến thức trọng tâm của 3 năm cấp 3 được hệ thống khoa học – ngắn gọn – dễ nhớ, bám sát cấu trúc đề thi THPT Quốc Gia.
Dù bạn học tự nhiên hay xã hội, bộ sách đều có phiên bản phù hợp để bạn nắm chắc kiến thức – tăng tốc ôn luyện – tự tin chinh phục điểm cao!



